Institut für Pharmakologie und Toxikologie
Forschung
Der Schwerpunkt der wissenschaftlichen Arbeit am Institut liegt auf dem Gebiet der translationalen Forschung mit dem Ziel molekulare Krankheitsmechanismen aufzuklären und pharmakologische Angriffspunkte für die Entwicklung neuer medikamentöser Therapiestrategien zu identifizieren.
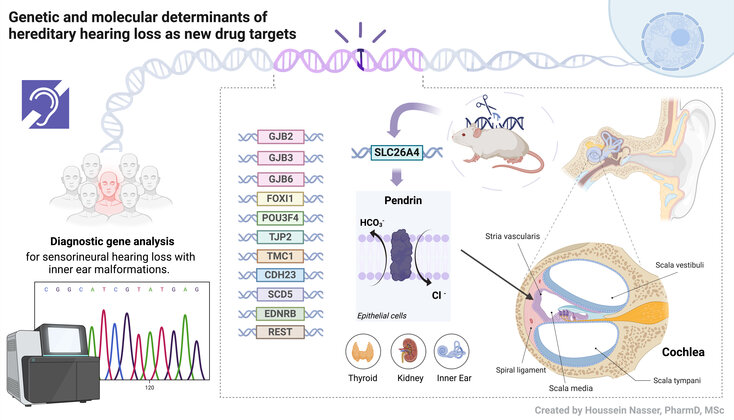
Der Forschungsschwerpunkt des Instituts für Pharmakologie und Toxikologie ist das Verständnis der genetischen und molekularen Mechanismen des syndromalen (Pendred-Syndrom) und des nicht-syndromalen malformativen Hörverlusts. In Zusammenarbeit mit der Klinik für Hals-Nasen-Ohren-Heilkunde (Prof. G. Rasp und Dr. S. Rösch) der Salzburger Landeskliniken (SALK) haben wir die erste österreichische Kohorte von Patient*innen mit Hörverlust mit vergrößertem vestibulären Aquädukt (EVA) untersucht, einer der häufigsten Ursachen des sensorineuralen Hörverlusts (Roesch et al., Int J Mol Sci 2018). Das SLC26A4-Gen, das für den Anionenaustauscher Pendrin kodiert, ist häufig bei Patient*innen mit Pendred-Syndrom und nicht-syndromischem EVA mutiert.
Ziel der Forschung ist ein genaueres Verständnis der molekularen Störungen, die zum Verlust der Funktion pathogener Varianten des Pendrin-Proteins führen, einschließlich struktureller Änderungen, zellulärer Fehllokalisierung, gestörtem Proteinumsatz und veränderter Gentranskription. Der mögliche Beitrag weiterer Gene, unter anderem auch der Connexine GJB2, GJB3 und GJB6, sowie Transkriptionsfaktoren wie FOXI1 und POU3F4 bei der Bestimmung von malformativem Hörverlust wird ebenfalls untersucht. Zusätzlich möchten wir neue Gene und Genveränderungen im Zusammenhang mit Hörverlust identifizieren, die bisher ungeklärte Krankheitsbilder bei Patient*innen erklären können. Ziel ist es, Strategien für die Entwicklung zukünftiger Therapien zu identifizieren.
Zentrale Publikationen
Jonard L, Brotto D, Moreno-Pelayo MA, del Castillo I, Kremer H, Pennings R, Caria H, Fialho G, Boudewyns A, Van Camp G, Oldak M, Ozieblo D, Deggouj N, De Siati R, Gasparini P, Girotto G, Verstreken M, Dossena S, Roesch S et al. Genetic Evaluation of Prelingual Hearing Impairment: Recommendation of an European Network for Genetic Hearing Impairment. Audiology Research, 2023; 13(3):341-346
Bernardinelli E, Roesch S, Simoni E Marino A, Rasp G, Astolfi L, Sarikas A and Dossena S. Novel POU3F4 variants identified in patients with inner ear malformations exhibit aberrant cellular distribution and lack of SLC6A20 transcriptional upregulation. Front Mol Neurosci. Sept 2022.
Roesch, S; Bernardinelli, E; Nofziger, C; Tóth, M; Patsch, W; Rasp, G; Paulmichl, M; Dossena, S; Functional Testing of SLC26A4 Variants-Clinical and Molecular Analysis of a Cohort with Enlarged Vestibular Aqueduct from Austria. Int J Mol Sci. 2018; 19(1):
Pera A, Dossena S, Rodighiero S, Gandía M, Bottà G, Meyer G, Moreno F, Nofziger C, Hernández-Chico C, Paulmichl M. Functional assessment of allelic variants in the SLC26A4 gene involved in Pendred syndrome and nonsyndromic EVA. Proc Natl Acad Sci U S A. 2008;105:18608-18613
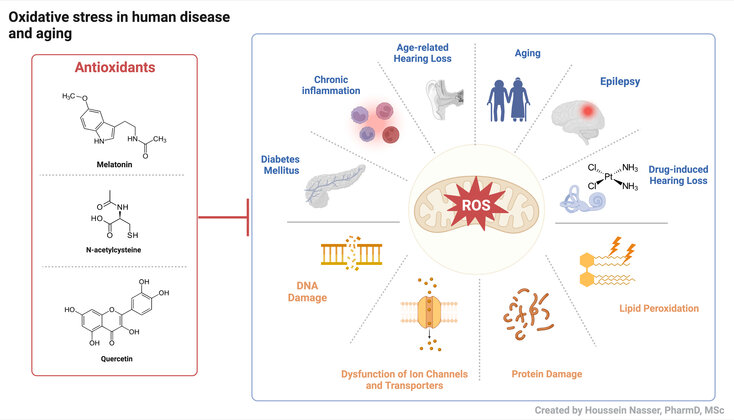
Reactive Oxygen Species (ROS) sind hoch reaktive Moleküle, die normalerweise durch den Zellstoffwechsel oder als Folge der Exposition gegenüber Umweltfaktoren und Xenobiotika entstehen. Wenn ROS sich über die antioxidative Kapazität biologischer Systeme hinaus akkumulieren, entsteht ein Zustand, der als oxidativer Stress (OS) bezeichnet wird. OS liegt verschiedenen pathophysiologischen Veränderungen im Körper wie Diabetes Mellitus, Hörverlust, Epilepsie und der Alterung zugrunde. Ziel der Forschung ist die Identifizierung von zellulären und molekularen Targets von OS, mit dem Schwerpunkt auf Ionenkanälen und Transportern, und die Erforschung der Verwendung von Antioxidantien, um den schädlichen Auswirkungen von OS auf Zellebene entgegenzuwirken.
Zentrale Publikationen
Spinelli S, Remigante A, Liuni R, Mantegna G, Legname G, Marino A, Morabito R, Dossena S. Oxidative stress-related cellular aging causes dysfunction of the Kv3.1/KCNC1 channel reverted by melatonin. Aging Cell. 2024 May 9:e14185.
Remigante A, Spinelli S, Zuccolini P, Gavazzo P, Marino A, Pusch M, Morabito R, Dossena S. Melatonin protects Kir2.1 function in an oxidative stress-related model of aging neuroglia. Biofactors. 2023 Dec 14
Remigante A, Spinelli S, Trichilo V, Loddo S, Sarikas A, Pusch M, Dossena S, Marino A, Morabito R. d-Galactose induced early aging in human erythrocytes: Role of band 3 protein. J Cell Physiol. 2022 Feb;237(2):1586-1596.