Institut für Pharmakologie und Toxikologie
Forschungsdienstleistungen
Das Institut für Pharmakologie und Toxikologie bietet folgende Methoden und Analysen im Rahmen von Diagnostik-Service und wissenschaftlichen Kollaborationsprojekten für akademische Einrichtungen und Firmen an:
Moderne Patch-Clamp-Einheit, bestehend aus einem EPC 10 USB-Verstärker (HEKA, Deutschland), einem pneumatischen Vibrationsschutztisch, einem piezoelektrischen Mikromanipulator (Scientifica) und einem inversen Phasenkontrastmikroskop (Motic AE31) mit Fluoreszenz- und FITC- und TRITC-Emissionsfilter zur Identifizierung transfizierter Zellen, Perfusionssystem mit ALA VC4-Ventilsteuerung und Vakuumpumpe, Macintosh-Computer, auf dem die Erfassungssoftware PatchMaster ausgeführt wird. Die Benutzer haben Zugang zu einem horizontalen Abzieher (Sutter Instruments) und einer Mikroforge (Narishige) zum Bau von Elektroden sowie zu einem Zellkulturraum der Biosicherheitsstufe II.
Die Elektrophysiologie Einheit ist Teil von COMPCEL. Nähere Informationen zu COMPCEL (Competence Center for Electrophysiology) finden Sie bitte hier.
Die ABR (auditory brainstem activity) Workstation kann akustische Gehirnstamm-Aktivitäten aufzeichnen, wodurch sowohl die Funktion von kochleären und retrokochleären Signalwegen als auch die Distorsionsprodukte otoakustischer Emissionen (DPOAE) dargestellt werden können, die im Besonderen die Aktivität von äußeren Cochlea-Haarzellen des Corti Organs darstellen. Zusätzlich ist das System darauf konfiguriert, mittels Kopfhautelektroden oder implantierter Schädelelektroden, die auf Stimulationen verschiedener Art reagieren, hervorgerufene Potentiale aus jeder Gehirnregion aufzunehmen. Das System steuert auch Zubehörteile anderer Anbieter wie Mini Shaker (Schwingungsanlagen), Lichtquellen wie LEDs, und thermoelektrische Apparate. Zusätzliche Komponenten und Software ermöglichen es dem System, die Spike-Aktivität einzelner Neuronen aufzunehmen oder Systeme für die Verhaltensneurowissenschaft zu steuern.
Die ABR Workstation ist von der Firma Tucker-Davis Technologies (TDT), die seit über 30 Jahren im Bereich der Signalprozesse und auditorischen Neurowissenschaften tätig ist und von Experten einstimmig als bester Anbieter von auditorischen Forschungsgeräten ausgezeichnet wurde. Sie befindet sich im konventionellen Bereich der Tierhaltung an der PMU Salzburg.
Die ABR Workstation ist Teil von COMPCEL. Nähere Informationen zu COMPCEL (Competence Center for Electrophysiology) finden Sie bitte hier.
Das Institut für Pharmakologie und Toxikologie besitzt die vom Bundesministerium für Arbeit, Soziales, Gesundheit und Konsumentenschutz (Österreich) erteilte Zulassung zur diagnostischen Genanalyse (Zulassungsnummer: BMASGK-76120/0007-IX / B / 16c / 2018). Die analysierten Gene sind GJB2, GJB6, SLC26A4 und POU3F4, die alle eine fundamentale Rolle bei der Pathogenese des sensorineuralen Hörverlusts spielen, die mit Fehlbildungen des Innenohrs zusammenhängt. Weitere Gene werden für Forschungszzwecke untersucht.
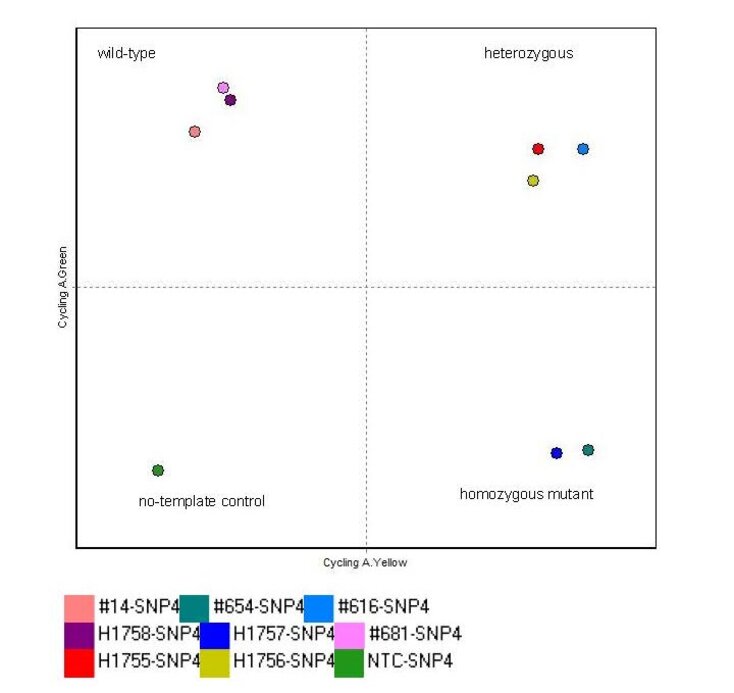
Einzelnukleotidpolymorphismus (SNP) Assays bestimmen Prävalenz und den Genotyp eines oder mehrerer SNPs in einer Patientenkohorte. Hierzu wird genomische DNA durch eine automatisierte EZ1 Advanced XL-Plattform (Qiagen) aus nicht mehr als 350 ul peripherem Blut extrahiert und mittels Realtime-PCR mit allelspezifischen Primern und einem sondenbasierten Reportersystem auf dem Rotor Gene Q (QIAGEN) analysiert. 72 Proben können gleichzeitig analysiert werden.
Die Untersuchung der Proteinexpression in einem subzellulären Kompartiment oder die Kolokalisierung von zwei oder mehr Proteinen in der Zelle sind nützliche Strategien zur Aufklärung von Proteinfunktion, Interaktion und zellulärem Proteintrafficking. Die Kolokalisierung von nativen oder rekombinanten Proteinen in lebenden oder fixierten Zellen wird quantifiziert und statistisch ausgewertet, um Unterschiede zwischen Proteinvarianten oder verschiedenen Bedingungen aufzudecken. Marker von Zellkompartimenten wie Zellkern, Plasmamembran, endoplasmatisches Retikulum, Golgi-Komplex, Mitochondrien und Autophagosomen ermöglichen die Identifizierung des spezifischen subzellulären Kompartiments eines Proteins. Durch Fluorescence Resonance Energy Transfer (FRET) wird die Identifizierung und direkte Interaktion zwischen Proteinpaaren und lebenden oder fixierten Zellen unter verschiedenen Laborbedingungen ermöglicht. Die molekulare Bildgebung wird mit einem konfokalen Leica TCS SP5 II-Mikroskop durchgeführt, das mit 4 Lasern und 8 Anregungswellenlängen (405, 458, 476, 488, 496, 514, 561, 633 nm) ausgestattet ist.
Echtes konfokales System, ausgestattet mit 4 Lasern (Diode, Argon, DPSS, Helium / Neon) mit 8 Anregungslinien (405, 458, 476, 488, 496, 514, 561, 633 nm), konventioneller und resonanter Scanner für schnelle Aufnahmegeschwindigkeit akustooptischer Strahlteiler (AOBS) zur besseren Übertragung des emittierten Lichts, akustooptisch abstimmbarer Filter (AOTF) zur Feinsteuerung der Laserleistung, 3 Photomultiplier (PMTs) mit Spektraldetektoren zur freien Wahl des Emissionsfensters und ein Hybrid Detektor (hyD) zur optimalen Signal-Rausch-Verhältnis-Erfassung im roten Emissionsbereich, 5 Objektive (10x, 20x, 40x und zwei 63x) einschließlich eines 63x-Immersionsobjektivs zur Abbildung lebender Proben, Temperatur-, Feuchtigkeits- und CO2-Kontrolle. Das konfokale Mikroskop befindet sich in einem Laborraum für Biosicherheitsstufe II, der mit einer Hood für die Biosicherheitsstufe II, einem Inkubator für Zellkultur, einem Kühlschrank, einem Gefrierschrank, einer kleinen Dunstabzugshaube und einem System mit entionisiertem Wasser des Typs III ausgestattet ist.