Institut für Experimentelle und Klinische Zelltherapie
Forschungsprojekte
"Advances in Extracellular Vesicle Research Over The Past Decade: Source And Isolation Method Are Connected with Cargo And Function"
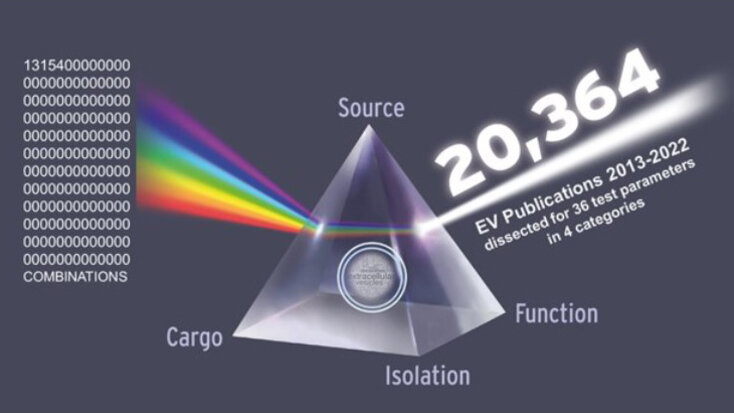
Eine gesamte Dekade der Vesikel-Forschung – und damit 20.364 Originalartikel – hat ein Forscher*innen-Team des Instituts für Experimentelle und Klinische Zelltherapie der Paracelsus Medizinischen Privatuniversität (PMU) in Salzburg untersucht. Es handelt sich um die größte bisher durchgeführte Meta-Analyse von Daten aus der Vesikelforschung.
Die Autor*innen um Dr. Rodolphe Poupardin, Dr. Martin Wolf, Dr. Nicole Maeding und Institutsvorstand Univ.-Prof. Dirk Strunk haben alle 20.364 Originalartikel aus der Forschung an extrazellulären Vesikeln (EV) in der biomedizinischen Meta-Datenbank PubMed durch die Kombination von 10 Schlüsselwörtern und 3 medizinischen Fachbegriffen für das Jahrzehnt 2013-2022 identifiziert & detailliert analysiert.
Unter Berücksichtigung von 1,32 x 10155 möglichen Stichwort-Kombinationen wurden die Ergebnisse durch maschinelles Lernen in einfach verständlichen grafischen Informations-Landschaften dargestellt und mittels Korrelationsanalyse weiter aufgeschlüsselt. Konzeptionell relevante Assoziationen in den vier Kategorien EV-Quelle, Isolierung, Cargo und Funktion wurden identifiziert und strategische Schlussfolgerungen für zukünftige Forschungsfragen präsentiert.
„Es konnte gezeigt werden, dass die Quelle der extrazellulären Vesikel sowie die Isolierungsmethode hochsignifikant Einfluss haben auf die damit auslösbare Funktion – nicht allen Autor*innen der Arbeiten war das bisher so bewusst. Überraschend war, dass häufig genutzte Verfahren wie Ultrazentrifugation kaum mit positiven funktionellen Daten korrelieren. Das bedeutet, dass diese Meta-Analyse das Potential hat, einen Umbruch in der EV-Technologie auszulösen.
Jede angestrebte Anwendung braucht ihr spezielles Herstellungsverfahren“, so Prof. Dirk Strunk, Vorstand des Instituts für Experimentelle und Klinische Zelltherapie.
Die Arbeit „Advances in Extracellular Vesicle Research Over The Past Decade: Source And Isolation Method Are Connected with Cargo And Function“ des Forscher*innen-Teams wurde am 25.01.2024 in der Fachzeitschrift „Advanced Healthcare Materials“ (Impact Factor: 10.0) veröffentlicht:
https://onlinelibrary.wiley.com/doi/10.1002/adhm.202303941
„The enhancer landscape predetermines the skeletal regeneration capacity of stromal cells“
Knochen heilen – aber nicht immer gleich gut und gleich schnell. Mehr als eine Million Menschen jährlich leiden weltweit an Problemen durch verzögerte oder anderweitig gestörte Heilung von Knochenbrüchen. Die Ursachen sind vielfältig, die Behandlung langwierig und nicht immer erfolgreich. Verschiedene Stammzelltherapien befinden sich derzeit in der klinischen Entwicklung, konnten jedoch bisher die in sie gesetzten Hoffnungen noch nicht erfüllen. Forschende der Paracelsus Medizinischen Privatuniversität (PMU) in Salzburg konnten jetzt gemeinsam mit Expert*innen der Charité in Berlin und weiteren Kooperationspartner*innen einen neuen Mechanismus der epigenetischen Regulation der Knochenheilung entdecken:
„Über den Erfolg einer Gewebe-Regeneration entscheidet ein komplexes Netzwerk sogenannter Enhancer. Dabei handelt es sich um organspezifische Verstärker der Genexpression, also der Art und Weise, wie ein Gen in Erscheinung tritt. Erstmals konnte jetzt gezeigt werden, dass nur Stamm- und Vorläuferzellen aus dem Bewegungsapparat die passende Signatur jener Enhancer besitzen, die für eine vollständige Knochenheilung erforderlich ist“, berichtet Univ.-Prof. Dirk Strunk, Leiter des Instituts für Experimentelle und Klinische Zelltherapie der PMU.
Die Enhancer bilden den Kallus, ein Narbengewebe als Vorstufe der Heilung und leiten die vollständige Regeneration der Fraktur ein. Erst danach kann der junge Knochen von körpereigenen Zellen vollständig re-modelliert werden. Stammzellen aus anderen Geweben fehlt dieser Verstärkermechanismus.
„Damit ist nicht nur ein wichtiger Schritt zur Auswahl der geeigneten Zellen für eine effektive Behandlung schwer heilender Knochenbrüche gelungen. Das Wissen um derartige organspezifische Enhancer-Signaturen wird auch zur Verbesserung anderer Stammzellbehandlungen beitragen“, so Strunk.
Die Arbeit („The enhancer landscape predetermines the skeletal segeneration capacity of stromal cells“) der internationalen Forschungsgruppe wurde am 22.03.2023 im hochrangigen Fachmagazin „Science Translational Medicine“ (Impact-Factor 19,3) online veröffentlicht:
www.science.org/doi/10.1126/scitranslmed.abm7477